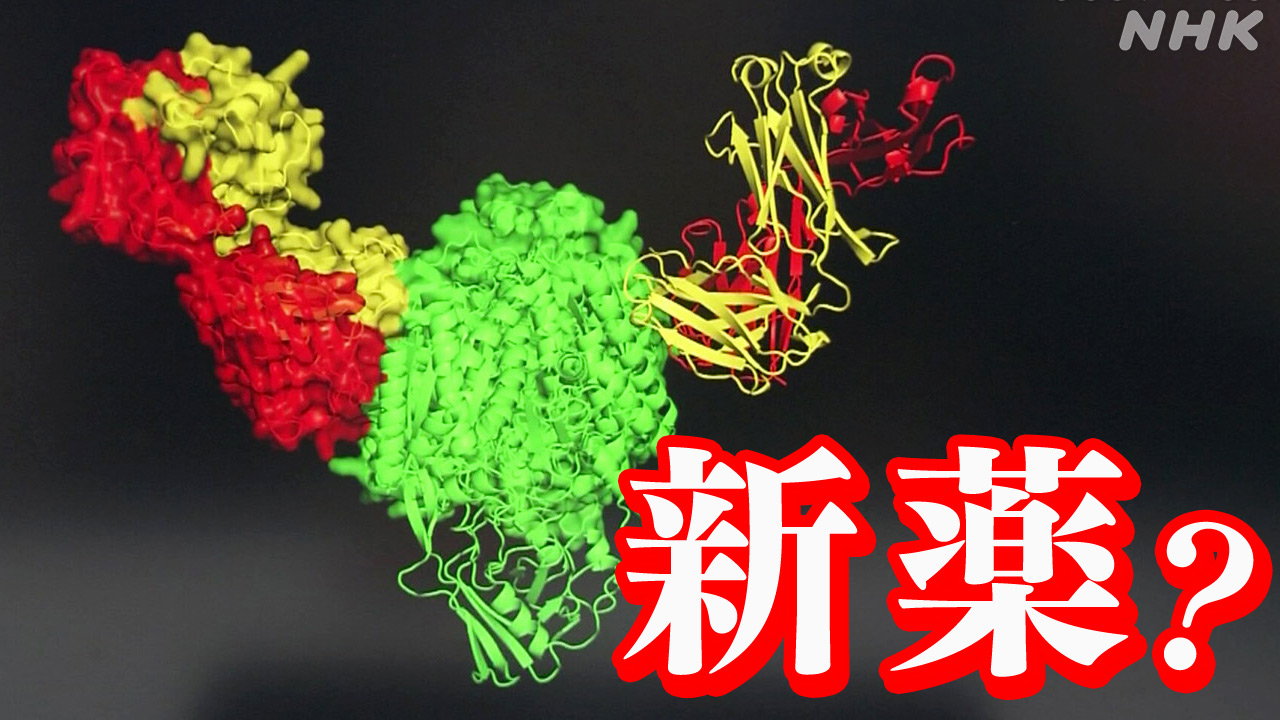
「今まで患者が少なくて研究が進まなかった病気の薬の開発も進んでいくと思う」
バイオベンチャー企業の担当者は、そう手応えを話した。
ことしのノーベル化学賞を、関連する研究が受賞したことで注目される“AI創薬”。
私たちの生活や研究のあり方をどう変えようとしているのだろうか。そもそも仕組みは?安全性は?研究の最前線を追った。
(科学文化部記者 島田尚朗)
治療薬の候補 人が思いつかない提案も
AIを使って開発された薬はすでに、臨床試験にまで進んでいる。
国内の大手製薬会社、アステラス製薬。

ラボを訪ねた私たちに紹介されたのは、シャーレの中に入った、白い粉末だ。
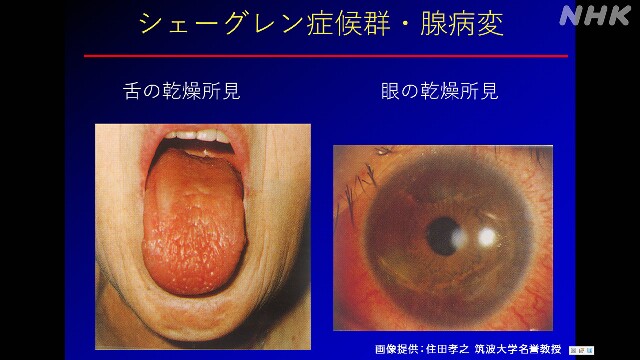
国の指定難病の「シェーグレン症候群」の治療薬の候補として開発された「ASP5502」だという。

「シェーグレン症候群」は自己免疫疾患のひとつだ。
涙や唾液が出づらくなり、ドライアイやドライマウスのほか、関節痛や皮膚に紅斑が現れる症状などが出ることもある。国内で少なくとも7万人の患者がいると推計されているが、根本的な治療法は確立していない。
この病気を引き起こす原因のひとつが「STING」と呼ばれる、たんぱく質と考えられている。会社では、このたんぱく質の働きを阻害する「薬の候補」となる化合物をAIに考えてもらった。

するとAIは、たんぱく質の構造などを分析し、わずか1時間ほどで6万種類もの薬の候補となる化合物を提案してきた。
さらに「体内で安定化するか」「体内で溶けるか」「ヒト、マウス、ラットでの安全性はどうか」といった、独自の指標をシミュレーションしスコア化。
効果が高くて薬になりやすい上位23種類の化合物を、スコアの順位や根拠となる評価を示しながらパソコン画面上に表示した。

あとはロボットにデータを入力すれば、化合物を自動で合成。製造の実現可能性や有効性の検証などを経て、残った1つが先ほどの薬の候補「ASP5502」だった。
会社では、ことし9月からアメリカで、この薬を健康な人に投与する臨床試験の第一段階を始めている。
AIを使った創薬事業を始めて5年。研究担当の志鷹義嗣 専務担当役員は手応えを感じている。

アステラス製薬研究担当
志鷹義嗣 専務担当役員
「AIが提案してきたものは我々の熟練の研究者でも最初には思いつかないような構造をしていた。懐疑的な意見も研究者の中にはあったが、合成してみたところ、臨床試験に進めるような化合物だった。まだ標準治療がない難病疾患はたくさんあり、そういった疾患に対する創薬を加速化するために、AIをどんどん使っていきたい」
シェーグレン症候群の患者からも期待の声が上がっている。

日本シェーグレン症候群患者の会
下司朋枝 副会長
「この疾患は人によって症状や程度もさまざまで、中には1日中アメをなめていないと乾燥して喋れない、物が飲み込めない、眠れない、そしゃくできないといった症状が出る人もいる。希少性が高い病気のため、周囲の理解を得るのが難しく、精神的な苦痛もある。そんな中、AIによる創薬で希少性の高い病気に光を当ててくれたことに多くの人が期待していると思う」
たんぱく質 構造解析って?
ではそもそも新しい薬は、どのように開発されるのか。
薬とたんぱく質の関係を研究して40年余り、創薬が専門の横浜薬科大学の北川康行教授に聞いた。

北川教授は「薬を開発する上では、『たんぱく質の構造』を知ることが最も大事なこと」と話す。
たんぱく質は、20種類のアミノ酸が“ひも状”にいくつも連なったものだ。このひもの状態から、複雑に折りたたまれ、立体的な構造になることで、機能や働きを持つことになる。
たんぱく質と聞くと、筋肉のもとになる栄養源のようなイメージがあるが、それだけではない。生き物が生きていくために必要な酵素や抗体などとして機能する一方で、病気の原因になるものもあるという。

そして立体構造となった、たんぱく質の一部分には「結合ポケット」という場所がある。病気の原因となっているたんぱく質の場合、この「結合ポケット」に、ピッタリと合う別のたんぱく質などをくっつけることで“悪さを止める”ことができる。
イメージとして「鍵と鍵穴」を組み合わせることによく例えられる。鍵が「薬」で、鍵穴がたんぱく質の「結合ポケット」だ。
薬を開発するには、原因となっているたんぱく質の結合ポケットが、どのような構造になっているのかをまず知る必要があるという。

横浜薬科大学
北川康行 教授
「たんぱく質の構造が分からないと、薬の開発は難しい。(薬が)良いたんぱく質に作用すると悪影響になるし、効き過ぎでもいけません。悪いたんぱく質だけに作用するためにも構造を知ることが非常に重要になってきます。こうしたステップの中で外れていく薬の候補もたくさんあるので、みなさんが飲んでいる薬は非常に労力と時間がかかって、できているということです」
実測から予測へ AIの役割は
では、たんぱく質の構造はどうやって解析するのか。
「たんぱく質の折りたたみ問題」と言われるほどその立体構造の解析は複雑で難しく、長年の課題となってきた。
具体的には▽X線を使う方法や、▽たんぱく質を凍らせて、立体的な形を調べるクライオ電子顕微鏡を使った方法などが解析に使われている。

これらの方法は精密で信頼性が高い一方で、課題もある。
例えばX線では、たんぱく質を結晶化する(規則正しくきれいに並べる)必要があるが、これには時間や費用がかかる。また一部のたんぱく質は結晶化できず、解析が難しい場合もある。
クライオ電子顕微鏡は結晶化が不要だが、たんぱく質が小さすぎると形をはっきりと捉えられないことがある。
これに対して、構造を「実測」するのではなく、「予測」するのがAIを使った方法だ。

ことしのノーベル化学賞を受賞したイギリスのDeepMind社のデミス・ハサビス氏やジョン・ジャンパー氏らが開発したAI=人工知能のモデル、「AlphaFold」(アルファフォールド)は、まさにたんぱく質の構造を高精度に予測する。
このAIはすでに形が分かっているたんぱく質のデータを大量に学習することで、これまで多くの研究者が特定してきた2億種類以上のたんぱく質の構造を予測できるようになったという。

2018年に最初のバージョンがリリース。
ことし5月には、最新バージョンとなる「AlphaFold3」が公開され、さらに複雑な結合部位なども再現できるようになった。
コストと時間 劇的に削減
AIによるたんぱく質の構造予測は、薬の研究開発を加速すると期待されている。

新薬開発を行う都内のバイオベンチャーでは、薬の候補と標的たんぱく質の結合のしかたを、従来のX線を使った方法で1年余りの期間と1000万円以上の費用をかけて調べてきた。
ところが、ことし登場した「AlphaFold3」にこのたんぱく質のアミノ酸配列を入力すると、わずか5分余りで立体構造が再現された。

X線による構造解析結果と比較すると、両者の構造はかなり似ており、AIが高い精度で予測できたことを示していたという。利用料金も実質無料だった。
このバイオベンチャーは2001年に設立し、従業員はおよそ30人。規模が小さい会社でもAIのメリットを生かすことで、さまざまな薬を開発できると期待している。

ペルセウスプロテオミクス
萩原真二 研究開発部長
「AIが入ることで創薬の進め方は大きく変わる。コストやスピードに加えて、より良い医薬品が作れる可能性が広がるだろう。また、今まで患者が少なくて研究が進まなかった病気の薬の開発も進んでいくと思う。より多くの患者さんにさまざまな薬を提供できるようになると信じている」
AI創薬 安全性は?課題は?
一方、AIを使った創薬で気になるのがその安全性だ。
冒頭で紹介したアステラス製薬の担当者に聞いてみると、従来の創薬のプロセスにAIが組み込まれただけなので、安全性は従来と何も変わらないという。
AIが提案したものも、そのまま受け入れるのではなく、専門的な知識をもった人間が、細胞や動物実験による試験などで安全性を1つ1つ確認した上で、確度の高いものを実際に創っていく。
ただ、生命工学分野のAI活用に詳しい北里大学未来工学部の齋藤裕教授は、なぜこのような予測結果を導いたのかが説明できない「AIのブラックボックス化」についての課題は残っていると指摘する。

北里大学未来工学部
齋藤裕 教授
「AIによる予測は精度が高くなってきているが、なぜそのような予測をしたのかの思考プロセスや根拠などの過程が人間には一切分からない。ただ、今はそれを説明するためのツールやアプローチもそろいつつある。また仮に変なものが出たとしても、安全性の確認プロセスの中ではじかれると思う。大事なのは、AIを妄信しないことだ」
開発競争は激化 医療の未来は
新しい薬の開発にはこれまで10年前後にわたる長い歳月と、多額のコストがかかってきた。AIの活用が進めば、この時間とコストの大幅な削減につながることが期待されている。さらに治療法が確立していない希少疾患や難病に対する新薬の開発が進む可能性もある。
国内でも大学発のベンチャー企業や富士通やNECなど、製薬企業ではない、さまざまな業種の企業が次々と参入しているほか、世界各地でもAIを使った新薬の開発研究が活発だ。北里大学の齋藤教授は「AI創薬は群雄割拠の大戦国時代に突入している」と話す。
AI創薬が医療の未来にどのような変化をもたらしていくのか、今後が注目される。
12月22日(日)おはよう日本で放送予定

科学文化部 記者
島田尚朗
2010年入局
広島・静岡・福岡局を経て現所属
IT班でAIなどデジタル分野を担当

WACOCA: People, Life, Style.